G 단백질 연결 수용체
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
G 단백질 연결 수용체(GPCR)는 세포 외부 신호에 반응하여 세포 내 신호 전달 경로를 활성화하는 막 단백질의 일종이다. 1986년 로돕신과 β2 아드레날린 수용체의 발견으로 시작되어, 2012년 브라이언 코빌카와 로버트 레프코위츠가 노벨 화학상을 수상하며 연구가 활발히 진행되었다. GPCR은 7개의 막 횡단 나선을 가지며, A, B, C, D, E, F의 6가지 군으로 분류된다. 리간드 결합 시 G 단백질을 활성화시켜 cAMP 신호 전달 경로, 포스파티딜이노시톨 신호 전달 경로 등을 통해 다양한 생리적 기능을 조절한다. 시각, 미각, 후각, 행동 조절, 면역계 조절 등 다양한 생리적 과정에 관여하며, 탈감작, 수용체 조절을 통해 신호 전달을 조절한다. GPCR은 다양한 질병과 연관되어 있어 신약 개발의 주요 표적으로 활용된다.
더 읽어볼만한 페이지
- 수용체 - 광수용체
광수용체는 망막의 빛을 감지하는 세포로, 간상세포, 원추세포, ipRGCs로 구성되어 명암, 색깔, 생체 리듬 조절 등 시각 정보를 뇌로 전달하며, 이 과정의 이상은 시각 질환을 유발할 수 있다. - 수용체 - 에스트로겐 수용체
에스트로겐 수용체는 세포 내에서 에스트로겐과 결합하여 유전자 발현을 조절하는 단백질로, ERα와 ERβ의 두 가지 주요 아이소폼이 존재하며, 유방암, 폐경, 비만 등 다양한 질병과 관련되어 선택적 에스트로겐 수용체 조절제의 표적이 되고 비유전체적 신호 전달 경로에도 관여한다. - 막관통 단백질 - T세포 수용체
T세포 수용체(TCR)는 T 세포 표면의 이량체 단백질 복합체로, MHC 분자에 결합된 펩타이드를 인식하며, CD3 분자와 복합체를 이루어 신호 전달을 매개하고, V(D)J 재조합을 통해 다양한 항원 특이성을 갖는 T 세포 생성에 기여하여, CAR-T 치료 등 면역 요법 발전에 기여했다. - 막관통 단백질 - 인테그린
인테그린은 세포와 세포 외 기질 사이의 부착과 신호 전달에 관여하는 α와 β 단백질 소단위체로 구성된 이종이량체 막 단백질로서, 다양한 생물학적 과정에 관여하며 일부는 암세포 전이에 기여하고 혈전 관련 질환 치료의 표적이 된다. - 신호 전달 - 수용체 길항제
수용체 길항제는 수용체에 결합하여 작용제의 효과를 억제하는 물질로, 결합 부위 및 방식에 따라 다양한 유형으로 분류되며, 질병 치료 및 중독 해독 등에 활용된다. - 신호 전달 - 호르몬
호르몬은 특정 기관의 기능을 조절하는 정보 전달 물질로, 다양한 화학적 구조와 신호 전달 방식을 가지며, 척추동물의 성장, 발달, 생식, 신진대사 등 생리 과정에 관여하고, 의약품으로도 사용되지만 부작용의 위험이 있다.
2. 역사
1986년, 망막에 존재하는 광수용체인 로돕신과 심장에 존재하는 β2 아드레날린 수용체(β2AR)가 발견되었다. 이 두 분자는 국한된 영역과 기전이 달랐지만, "막을 7번 관통하는" 구조적인 공통점이 존재했다.[66]
GPCR은 아미노산 서열 및 기능적 유사성에 따라 크게 6개의 클래스로 분류된다.[12][13][14][15]
최초의 G 단백질 연결 수용체(GPCR)의 결정 구조는 2000년에 소의 망막에서 정제한 로돕신으로 결정되었다.[66] 그 전까지 같은 7번 막관통 단백질인 박테리오로돕신의 광 구동 수소 이온 펌프 구조 모델보다 복잡한 굴곡을 가졌으며, 7번 관통 헬릭스 후 짧은 8번째 헬릭스가 있는 G 단백질 연결 수용체에 공통적인 구조가 밝혀졌다.
2007년 브라이언 코빌카와 레이먼드 스테이브스 등에 의해, 의약품 표적으로서 처음으로 곤충 세포에서 발현된 β2-아드레날린 수용체 T4 리소자임 키메라 단백질의 결정 구조가 결정되었으며,[67] 2011년에는 활성화 상태의 β2-아드레날린 수용체와 G-단백질 삼량체의 결정 구조가 코빌카 그룹에 의해 규명되었다.[68]
2012년 노벨 화학상은 "G 단백질 연결 수용체의 기능 방식을 이해하는 데 결정적인" 업적을 이룬 브라이언 코빌카와 로버트 레프코위츠에게 수여되었다.[7][68] G 단백질 매개 신호 전달의 일부 측면에 대해 최소 7개의 다른 노벨상이 수여되었다.
현재까지 로돕신 패밀리인 클래스 A는 물론 클래스 B, 클래스 C, 클래스 F의 입체 구조가 이미 해명되었다. 2018년에 발표된 의약 산업 정책 연구소의 조사에 따르면, GPCR 표적의 신약 개발 품목 수는 개발약 전체의 20% (253/1265)를 차지하며, 주요 표적 분자군 중 하나가 되었다.[69]
3. 분류
A군은 가장 큰 군으로, GPCR 유전자의 거의 85%를 차지한다. A군 GPCR 중 절반 이상은 후각 수용체를 암호화하는 것으로 예측되며, 나머지 수용체는 알려진 내인성 화학 물질에 의해 리간드화되거나 고아 수용체로 분류된다. 로돕신 A군은 19개의 하위 그룹 (A1-A19)으로 더 세분화되었다.[11]
최근에는 척추동물 GPCR에 대해 GRAFS (글루탐산, 로돕신, ''부착'', 프리즐드/맛2, 세크레틴)라고 하는 대안적인 분류 시스템이 제안되었다.[9] 이는 고전적인 C군, A군, B2군, F군 및 B군에 해당한다.[61]
4. 구조
G 단백질 연결 수용체(GPCR)는 7개의 막 관통 도메인을 가진 적분 막 단백질이다.[24][25] 수용체의 세포 바깥쪽 부분은 당화될 수 있다. 세포 바깥쪽 루프는 수용체 구조를 안정화하기 위해 이황화 결합을 형성하는 두 개의 고도로 보존된 시스테인 잔기를 포함한다. 채널로돕신과 같이 GPCR과 유사한 일부 7-막 횡단 나선 단백질은 단백질 내부에 이온 채널을 포함할 수 있다.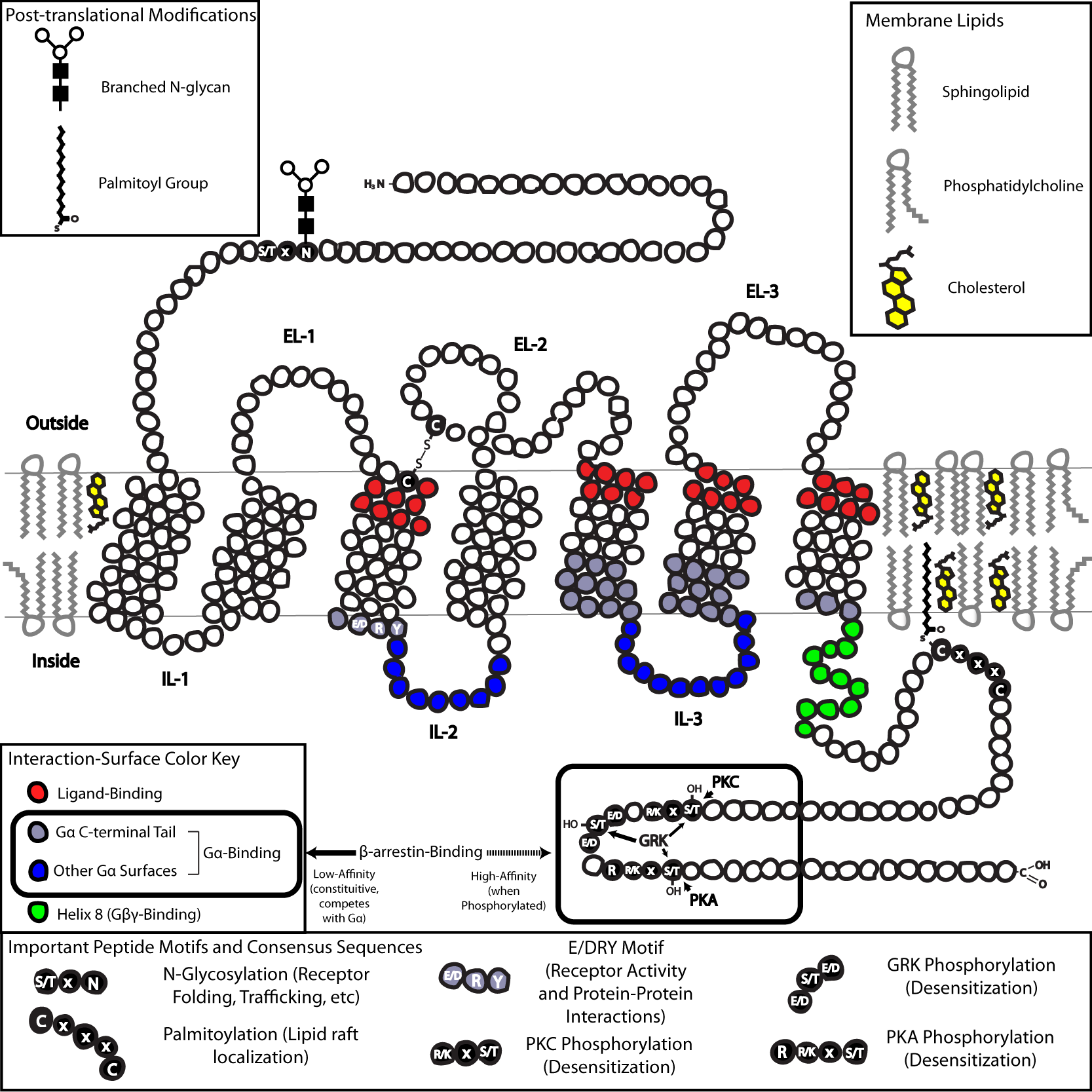
구조적으로 GPCR은 세포 바깥쪽의 N-말단, 7개의 막관통 (7-TM) α-나선(TM-1 ~ TM-7)과 3개의 세포 안쪽(IL-1 ~ IL-3) 및 3개의 세포 바깥쪽 루프(EL-1 ~ EL-3)로 연결되며, 마지막으로 세포 안쪽 C-말단으로 구성된다. GPCR은 7개의 막관통 나선이 세포막 내에서 리간드 결합 도메인 역할을 하는 공간을 형성하는 삼차 구조를 가진다. 이 공간은 종종 EL-2에 의해 덮여 있다. 리간드는 이 공간 외에 다른 곳에도 결합할 수 있는데, 부피가 큰 리간드(예: 단백질, 큰 펩타이드)는 세포 바깥쪽 루프와 상호작용하거나, C군 대사성 글루탐산 수용체(mGluR)의 경우 N-말단 꼬리와 상호작용한다. C군 GPCR은 큰 N-말단 꼬리를 가지며, 이 꼬리는 리간드 결합 도메인의 일부를 구성한다. mGluR에 글루탐산이 결합하면 N-말단 꼬리가 형태 변화를 일으켜 세포 바깥쪽 루프 및 TM 도메인의 잔기와 상호작용한다. 세 가지 유형의 작용제 유도 활성화의 최종 효과는 TM 나선의 상대적 방향 변화(비틀림 운동과 유사)를 통해 세포 안쪽 표면을 넓히고, 신호 전달 기능(G 단백질 결합)에 중요한 세포 안쪽 나선 및 TM 도메인의 잔기를 노출시키는 것이다. 역작용제와 길항제 또한 여러 다른 부위에 결합할 수 있지만, 최종 효과는 TM 나선 재배열을 막는 것이다.[2]
GPCR의 N-말단 및 C-말단 꼬리 구조는 리간드 결합 외에도 중요한 기능을 수행한다. 예를 들어, M3 무스카린 수용체의 C-말단은 Gq 단백질과의 사전 조립에 필수적이며, 특히 C-말단의 6개 아미노산 폴리염기성(KKKRRK) 도메인이 중요하다.[36] C-말단은 세린(Ser) 또는 트레오닌(Thr) 잔기를 포함하는 경우가 많은데, 이 잔기들이 인산화되면 β-arrestin이라는 스캐폴딩 단백질 결합에 대한 세포 안쪽 표면의 친화도가 증가한다.[37] β-어레스틴은 결합 후 입체적으로 G-단백질 결합을 방해하고 다른 단백질을 모아 세포 외 신호 조절 키나제(ERK) 경로 활성화 또는 수용체 세포내이입(내재화)에 관여하는 신호 복합체 생성을 유도한다. 이러한 Ser 및 Thr 잔기의 인산화는 GPCR 활성화 결과로 자주 발생하므로, β-arr 매개 G-단백질 탈결합 및 GPCR의 내재화는 둔감화의 중요한 기작이다.[38] 또한, 단일 GPCR, β-arr(꼬리 컨포메이션),[39][40] 및 이종삼량체 G 단백질로 구성된 내재화된 "메가 복합체"가 존재하며, 이는 엔도솜에서 단백질 신호를 설명할 수 있다.[41][42]
GPCR 사이의 마지막 일반적인 구조적 특징은 C-말단 꼬리 또는 세포 안쪽 루프의 하나 이상의 부위가 팔미토일화되는 것이다. 팔미토일화는 시스테인(Cys) 잔기에 소수성 아실기를 공유 결합시켜 변형하는 것으로, 콜레스테롤과 스핑고지질이 풍부한 지질 뗏목이라는 세포막의 미세 영역으로 수용체를 표적화하는 효과가 있다. GPCR의 많은 하위 신호 전달자 및 이펙터 분자(음성 피드백 경로 관련 분자 포함) 또한 지질 뗏목을 표적화하므로, 이는 신속한 수용체 신호 전달을 가능하게 한다.
GPCR은 생체 아민에서 양성자에 이르기까지 다양한 작용제에 의해 매개되는 세포 바깥쪽 신호에 반응하지만, 모두 G-단백질 결합 기작을 통해 신호를 전달한다. 이는 주로 IL-2 및 IL-3의 조합과 관련 TM 나선의 인접 잔기로 형성된 구아닌 뉴클레오티드 교환 인자(GEF) 도메인에 의해 가능하다.
2000년에 포유류 GPCR 중 처음으로 소 로돕신의 결정 구조가 밝혀졌다.[26] 2007년에는 사람 GPCR의 첫 번째 구조가 밝혀졌다.[27][28][29] 이 β2-아드레날린성 수용체 GPCR 구조는 소 로돕신과 매우 유사했다. 활성화되거나 작용제에 결합된 GPCR의 구조도 밝혀졌다.[30][31][32][33] 이 구조는 수용체의 세포 바깥쪽 리간드 결합이 세포질 쪽에 어떤 입체적 변화를 일으키는지 보여준다. 가장 큰 변화는 5번째 및 6번째 막 횡단 나선(TM5 및 TM6)의 세포질 부분의 바깥쪽 움직임이다. Gs와 복합체를 이룬 활성화된 베타-2 아드레날린성 수용체의 구조는 Gα가 이러한 움직임으로 생성된 공간에 결합한다는 것을 보여준다.[34]
GPCR은 미생물 로돕신 및 아디포넥틴 수용체 1 및 2(ADIPOR1, ADIPOR2)와 같이 7개의 막 횡단 도메인을 가진 다른 일부 단백질과 유사한 구조를 보인다. 그러나 이러한 7TMH(7-막 횡단 나선) 수용체 및 채널은 G 단백질과 연관되지 않는다. 또한 ADIPOR1 및 ADIPOR2는 막에서 GPCR과 반대 방향으로 배열되어 있다(GPCR은 일반적으로 세포 바깥쪽 N-말단, 세포질 C-말단을 갖는 반면 ADIPOR는 반대).[35]
4. 1. G 단백질의 구조
G 단백질은 Gα, Gβ, Gγ 3개의 소단위체(subunit)로 구성된 이종삼량체(heterotrimer)이다. Gα 소단위체는 GTP/GDP 결합 부위를 가지며, 활성화 상태에서는 GTP와 결합한다. Gα는 GαsAH와 GαsRas 두 부분으로 나뉜다. GαsRas는 GTP 가수분해에 필요한 촉매 역할을 하는 잔기(residue)를 포함하고 있으며, 작용체 단백질(effector protein) 및 Gβγ와의 결합 부위도 가지고 있다. GαsAH는 뉴클레오타이드(nucleotide) 방출 시 조개껍데기처럼 열리는 역할을 한다.
4. 1. 1. DXMS 분석법 이용
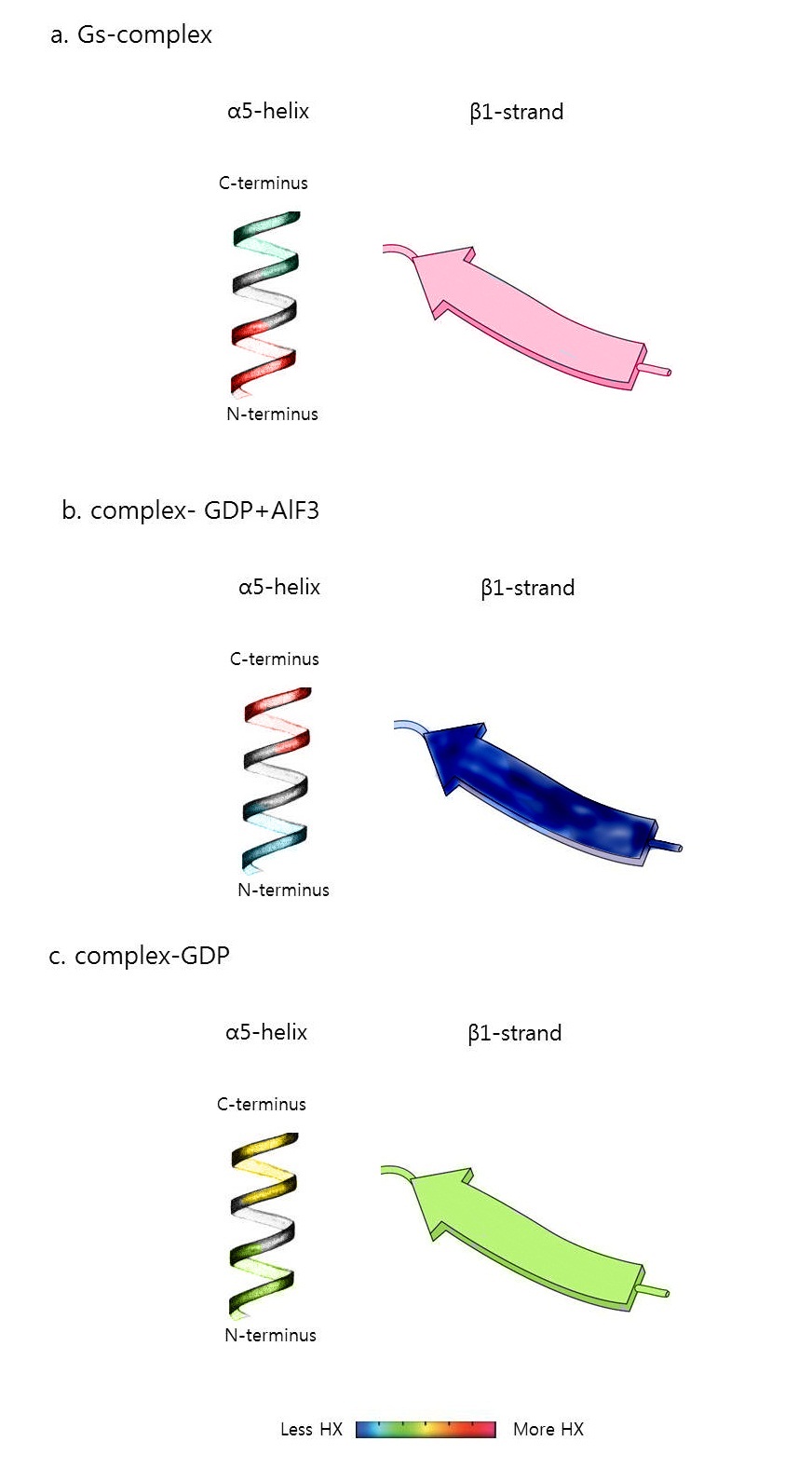
G 단백질이 활성화될 때 구조적인 변화를 더 구체적으로 분석하기 위해 결정 구조(Crystal structure)가 제시하는 정적인 통찰과 함께 DXMS(peptide amide hydrogen-deuterium exchange mass spectrometry)라는 분석법을 이용하였다. 이를 통해 좀 더 역동적인 통찰을 제시할 수 있었으며, 기존의 결정 구조에서 알 수 있었던 사실뿐만 아니라 결정 구조로는 밝혀낼 수 없었던 부분까지 밝혀낼 수 있었다.[1]
G 단백질이 이질삼합체를 이루고 있을 때와 Gα와 수용체가 복합체를 이루고 있을 때를 비교하면(그림5, a), Gα 단위체에서 α5-helix의 카복시 말단(C-terminus)은 감소된 수소-중수소 교환을 보였다. 이는 α5-helix가 복합체를 이룰 때 수용체를 관통한다는 것을 의미한다. 반면 α5-helix의 아미노말단은 증가된 교환을 보였는데, 이는 α5-helix의 아미노말단이 뉴클레오타이드 결합 부분에 관여하고 있기 때문이다. 복합체가 형성되면서 GDP가 떨어져 나가 뉴클레오타이드 결합 부위가 열리게 되고, 따라서 수소-중수소 교환이 증가하게 된다.[1]
복합체를 이루었을 때와 GDP+AlF3를 첨가했을 때를 비교하면(그림5, b), GDP+AlF3는 G 단백질과 결합했을 때 GTP와 구조적, 기능적으로 거의 같은 역할을 한다. GTP가 결합된 G 단백질은 수용체와 Gβγ 단위체로부터 분리된다. 따라서 Gα의 α5-helix는 노출되어 수소-중수소 교환이 증가한다. 반면 GDP+Al3의 결합으로 뉴클레오타이드 결합 부분은 닫히게 되고, 이에 따라 α5-helix의 아미노말단은 수소-중수소 교환이 감소하게 된다.[1]
GDP를 첨가했을 때는 GDP+AlF3를 첨가했을 때와 거의 유사한 양상을 보였다(그림5, c). 하지만 GDP+AlF3를 첨가했을 때만큼 변화된 양상을 보이지는 않았다. 이러한 결과는 GDP가 결합된 G 단백질의 α5-helix가 수용체와 약하게 결합하고 있다는 것을 시사한다.[1]
DXMS 분석이 밝혀낸 가장 두드러진 부분은 β1-strand의 구조적인 변화이다. β1-strand는 ICL2와 GDP의 β-phosphate를 조정하는 P-loop를 연결한다. 이 부분은 결정 구조에서는 작은 변화를 보이기 때문에 GDP 방출에 필요한 구조적인 변화를 잘 반영하지 못했다. 그러나 DXMS 분석법에서는 P-loop, α1, β1, 그리고 α5의 아미노말단이 GDP 방출 시 수소-중수소 교환 비율이 높게 나타났다. 결과적으로 DXMS 연구는 β1-P-loop-α1 구역이 아미드 골격 수소 결합(amide backbone hydrogen bond)을 변경시키는 구조적인 변화를 겪는다는 것을 밝혀냈다. 이를 통해 이들 부위가 뉴클레오타이드 결합에 관여한다는 것을 알 수 있게 되었다.[1]
또한 DXMS 분석을 통해 뉴클레오타이드 결합과 관련하여 GαsAH와 GαsRas (G 단백질은 GαsAH와 GαsRas로 구성되어 있다)는 조개껍질 같은 구조적인 변화를 겪는다는 것을 알아냈다. 뉴클레오타이드가 없을 때 이러한 조개껍질 같은 열림이 일어나는데, 이때 GαsAH는 자체로는 접힘과 구조가 거의 그대로이며 위치적으로만 재배열된다는 것을 확인하였다.[1]
결론적으로 DXMS 분석법은 결정 구조의 정적인 통찰을 보충하여 좀 더 자세하고 역동적인 통찰을 제시하였다. 이를 통해 G 단백질의 구조가 더 구체화되었다.[1]
5. 신호 전달
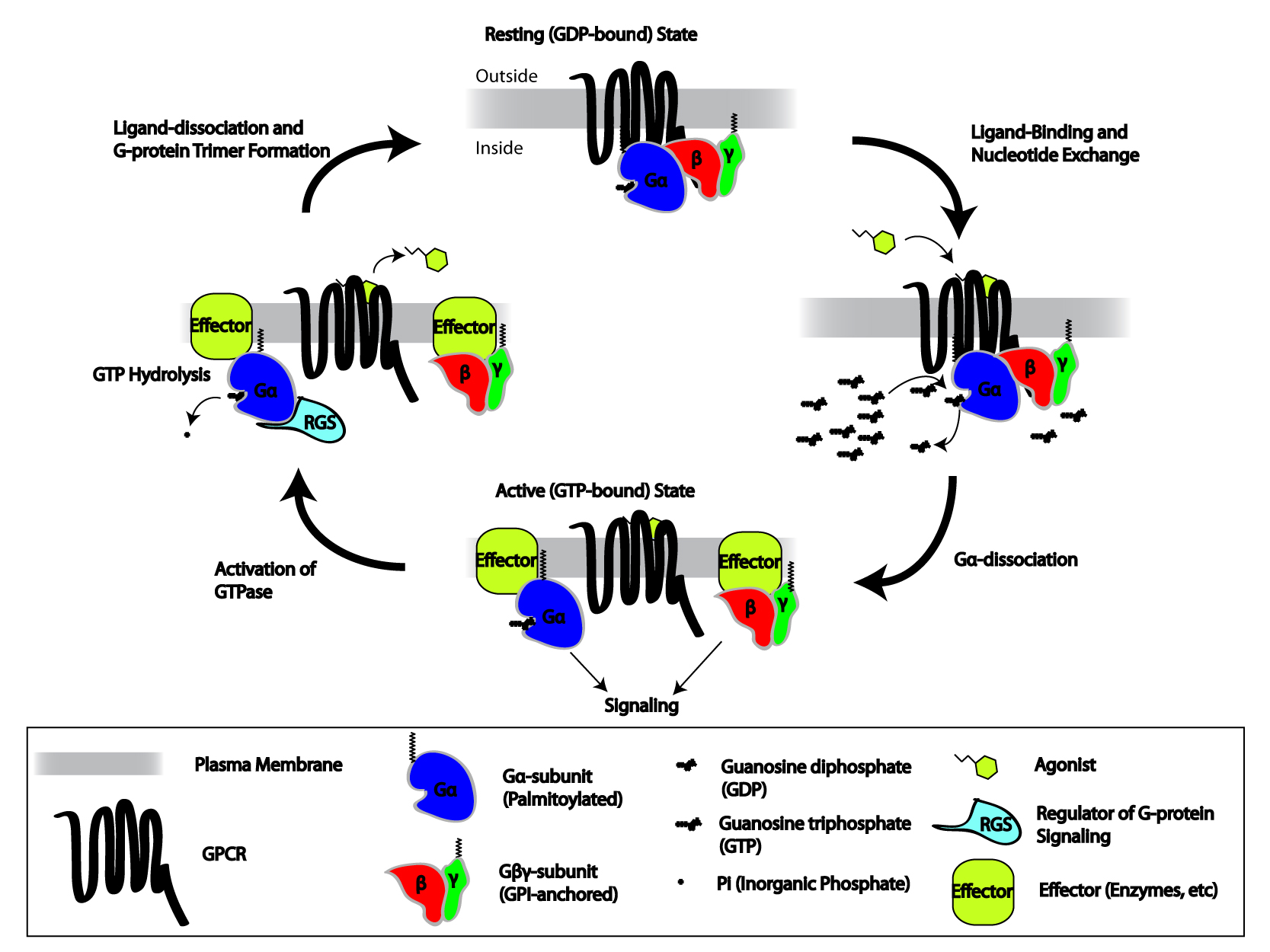
G 단백질 연결 수용체(GPCR)는 리간드 결합과 같은 외부 신호에 의해 활성화되어 G 단백질을 활성화시킨다. 활성화된 G 단백질은 다양한 하위 신호 전달 경로를 통해 세포 반응을 유도한다.[2] 2011년 GPCR과 G 단백질 삼합체(Gαβγ) 사이의 복합체 구조가 처음으로 밝혀지면서, 단백질 연구를 위한 새로운 장이 열렸다.
G 단백질 연결 수용체는 외부 신호에 의해 활성화된다. 이는 수용체에 입체 구조 변화를 일으켜 G 단백질의 활성화를 유발한다. 이후 G 단백질은 RGS 단백질에 의해 비활성화된다.[43]
G 단백질 연결 수용체는 다음과 같은 리간드에 대한 하나 이상의 수용체를 포함한다.[44]
- 감각 신호 매개체 (예: 빛 및 후각 자극 분자)
- 아데노신, 봄베신, 브라디키닌, 엔도텔린, GABA, 간세포 성장 인자(HGF), 멜라노코르틴, 신경펩티드 Y, 오피오이드 펩티드, 옵신, 소마토스타틴, 성장 호르몬(GH), 타키키닌, 혈관 활성 장 펩티드 계열 구성원, 바소프레신
- 바이오제닉 아민 (예: 도파민, 에피네프린, 노르에피네프린, 히스타민, 세로토닌, 멜라토닌)
- 글루탐산 (대사성 효과)
- 글루카곤
- 아세틸콜린 (무스카린 효과)
- 케모카인
- 염증의 지질 매개체 (예: 프로스타글란딘, 프로스타노이드, 혈소판 활성 인자, 류코트리엔)
- 펩티드 호르몬 (예: 칼시토닌, C5a 아나필락시독소, 난포 자극 호르몬(FSH), 생식샘 자극 호르몬 방출 호르몬(GnRH), 신경키닌, 갑상선 자극 호르몬 방출 호르몬(TRH), 옥시토신)
- 내인성 칸나비노이드
확인되지 않은 자극에 대한 수용체 역할을 하는 G 단백질 연결 수용체는 고아 수용체로 알려져 있다.
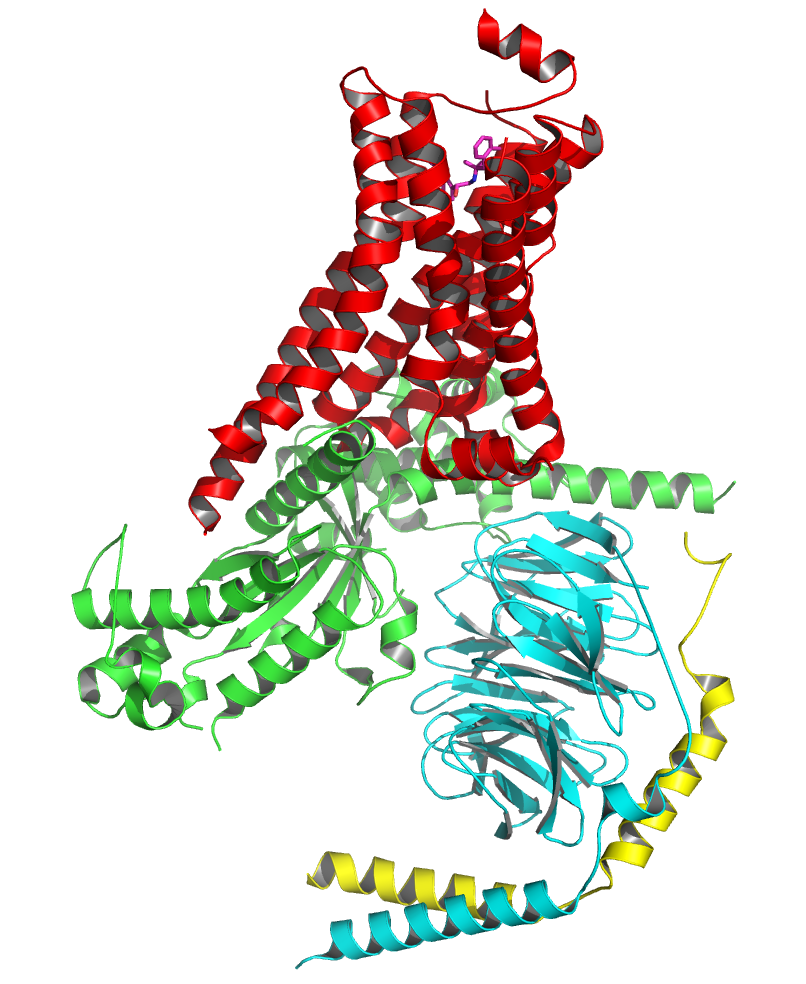
비활성 상태에서 GPCR은 이종 삼량체 G 단백질 복합체에 결합한다. 작용제가 GPCR에 결합하면 입체 구조 변화가 일어나 Gα 소단위체로 전달된다. 활성화된 Gα 소단위체는 GTP를 GDP 대신 교환하며, Gα 소단위체가 Gβγ 이량체 및 수용체로부터 해리된다. 해리된 Gα 및 Gβγ 소단위체는 다른 세포내 단백질과 상호 작용하여 신호 전달 연쇄 반응을 계속하는 반면, 자유로운 GPCR은 다른 이종 삼량체 G 단백질과 다시 결합하여 새로운 복합체를 형성한다.[45]
수용체 분자는 활성 및 비활성 상태 사이의 입체 구조 평형 상태로 존재한다.[46] 리간드가 결합하면 평형이 활성 상태로 이동할 수 있다. 작용제, 역 작용제, 중성 길항제의 세 가지 유형의 리간드가 존재한다. 활성 상태와 비활성 상태의 차이는 아직 명확하게 알려져 있지 않다.
GPCR의 하위 신호는 FAK와 같은 인테그린 신호와 상호 작용할 수 있다.[47] 인테그린 신호전달은 FAK를 인산화시키며, 이는 GPCR Gαs 활성을 감소시킬 수 있다.
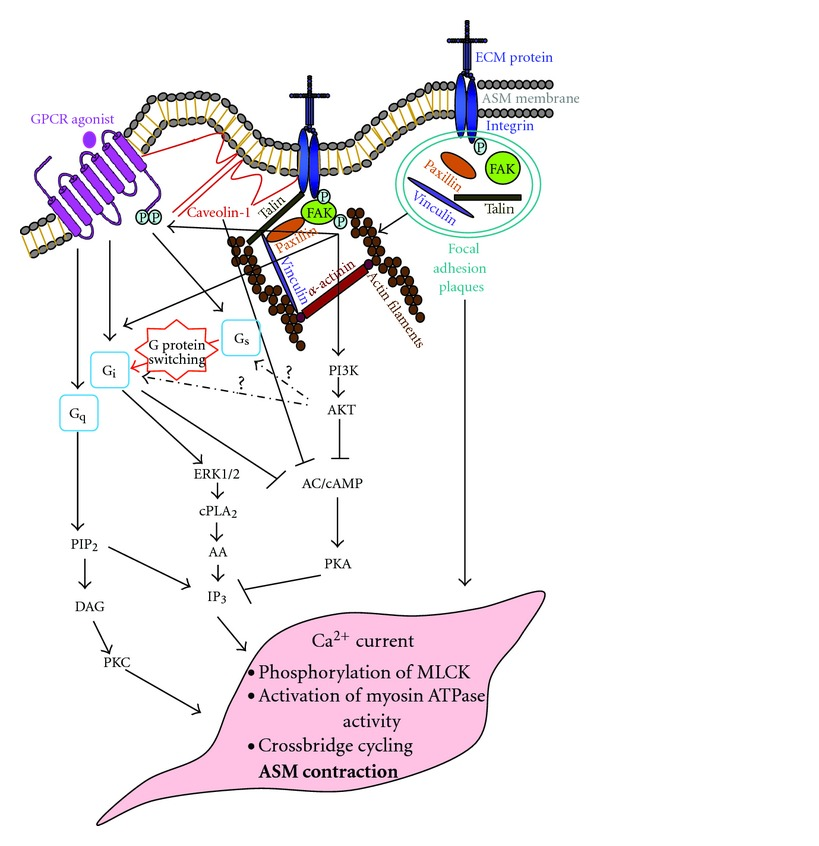
G 단백질 독립적인 기전을 통해 신호를 전달할 수 있으며, 이종 삼량체 G 단백질은 GPCR과 독립적으로 기능적인 역할을 할 수 있다. GPCR은 β-arrs, GRK, Src 등 G 단백질 의존적 신호 전달에서 그 역할이 언급된 많은 단백질을 통해 독립적으로 신호를 전달할 수 있다. 이러한 신호 전달은 생리학적으로 관련이 있는 것으로 나타났다.[48]
5. 1. G 단백질 매개 신호 전달
G 단백질 연결 수용체는 리간드와 같은 외부 신호에 의해 활성화된다. 이는 수용체의 구조 변화를 일으켜 G 단백질을 활성화시킨다. 추가적인 영향은 G 단백질의 유형에 따라 달라진다. G 단백질은 RGS 단백질에 의해 비활성화된다.수용체가 비활성화되면, GEF 도메인은 비활성화된 α-소단위체를 가진 이종삼합체 G 단백질에 결합될 수 있다. G 단백질은 α, β, γ 소단위체(각각 Gα, Gβ, Gγ)의 삼량체로, 구아노신 이인산(GDP)에 결합될 때 비활성화되지만, 구아노신 삼인산(GTP)에 결합될 때 활성화된다. 수용체가 활성화되면 GEF 도메인은 G 단백질의 α-소단위체에서 GDP를 GTP로 교환하여 G 단백질을 알로스테릭하게 활성화시킨다. 세포는 세포질 GTP:GDP 비율을 10:1로 유지하여 GTP로의 교환을 보장한다. G 단백질의 소단위체는 수용체와 서로 분리되어 Gα-GTP 단량체와 Gβγ 이량체를 생성하며, 이들은 다른 세포 내 단백질의 활성을 조절할 수 있다. 그러나 Gα의 팔미토일화와 Gγ의 C-말단에 공유 결합된 이소프레노이드 모이어티 때문에 확산이 제한된다.
Gα는 느린 GTP→GDP 가수분해 능력을 가지므로, α-소단위체의 비활성 형태(Gα-GDP)가 재생되어 Gβγ 이량체와 재결합하여 "휴지" G 단백질을 형성하고, 다시 GPCR에 결합하여 활성화를 기다린다. GTP 가수분해 속도는 G 단백질 신호 조절제(RGS 단백질)의 작용으로 가속화되는데, 이는 GTPase 활성화 단백질(GAP)의 일종이다. Gα-GTP와 상호작용 시 활성화/비활성화되는 많은 이펙터 단백질(예: 아데닐산 고리화 효소)도 GAP 활성을 갖는다. 따라서 GPCR-개시 신호는 자체 종료 능력을 갖는다.
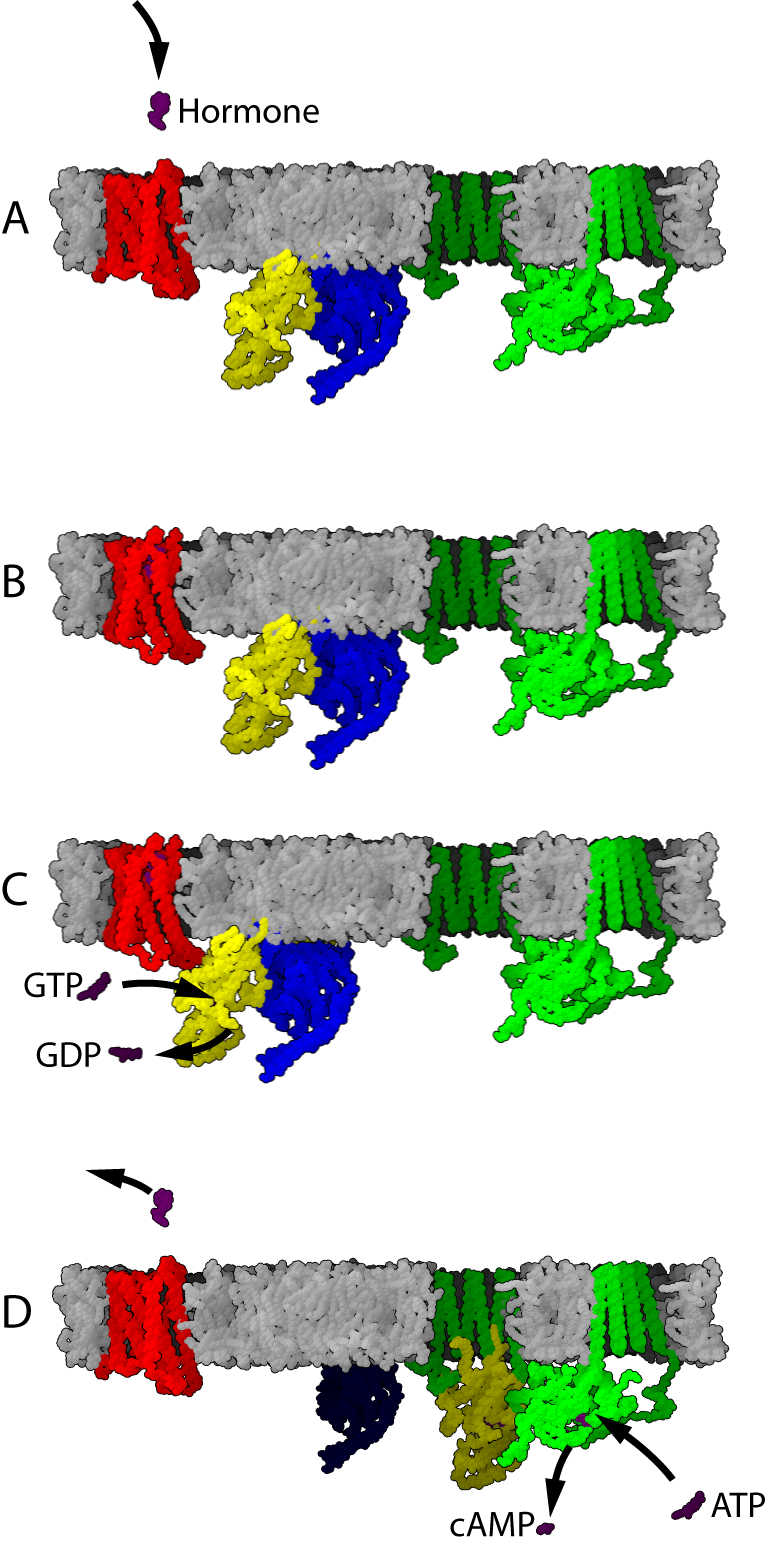
활성화된 수용체가 G 단백질과 만나면 활성화시킬 수 있다. 일부 증거에 따르면 수용체와 G 단백질은 미리 결합되어 있을 수 있다.[36] 예를 들어, G 단백질이 수용체에 결합하면 리간드에 대한 수용체의 친화력에 영향을 미친다. 활성화된 G 단백질은 GTP에 결합한다.
추가적인 신호 전달은 G 단백질의 유형에 따라 달라진다. 효소 아데닐산 시클라제는 G 단백질(G 단백질 Gs)에 의해 조절될 수 있는 세포 단백질의 예이다. 아데닐산 시클라제 활성은 활성화된 G 단백질의 소단위체에 결합할 때 활성화된다. G 단백질이 GDP 결합 상태로 돌아가면 아데닐산 시클라제의 활성화가 종료된다.
GPCR을 통해 활성화되는 신호 전달 경로는 GPCR 자체의 단백질 1차 구조 및 3차 구조에 의해 제한되지만, 궁극적으로 특정 리간드에 의해 안정화된 단백질 구조와 전달자 분자의 가용성에 의해 결정된다. 현재 GPCR은 G 단백질과 β-아레스틴의 두 가지 주요 전달자를 활용한다. β-아레스틴은 대부분의 GPCR의 인산화된 형태에 대해서만 높은 친화도를 가지므로, 대부분의 신호 전달은 G 단백질 활성화에 의존한다. 그러나 상호 작용 가능성은 G 단백질 독립적 신호 전달이 발생하도록 허용한다.
G 단백질 매개 신호 전달 경로는 3가지가 있으며, 4개의 하위 부류의 G 단백질(Gαs, Gαi/o, Gαq/11, Gα12/13)에 의해 매개된다. 각 G 단백질의 하위 부류는 여러 단백질로 구성되며, 각 단백질은 여러 유전자 또는 스플라이스 변이체의 산물로 다양한 차이를 가질 수 있지만, 일반적으로 4개의 부류로 분류된다. 다양한 βγ 조합의 신호 전달 특성이 서로 크게 다르지 않으므로, α-소단위체의 아이소폼에 따라 정의된다.[5]
대부분의 GPCR은 하나 이상의 Gα-서브타입을 활성화할 수 있지만, 한 서브타입을 선호하는 경향도 보인다. 활성화되는 서브타입이 GPCR에 결합된 리간드에 따라 달라지는 경우, 기능적 선택성이라고 한다. 그러나, 어떤 작동제의 결합도 GPCR의 GEF 도메인의 하나 이상의 컨포메이션을 안정화시킬 수 있으므로, 여러 G 단백질의 활성화를 시작할 수 있다. 또한, 피드백 경로는 G 단백질 선호도를 변경하는 번역 후 변형을 초래할 수 있다. GPCR의 선호하는 결합 파트너는 가장 명확하게 활성화되는 G 단백질에 따라 정의된다.
# Gαs 및 Gαi/o 경로의 이펙터는 사이클릭 아데노신 일인산(cAMP) 생성 효소인 아데닐산 시클라제(AC)이다. 포유류에는 10개의 AC 유전자 산물이 있으며, Gαs는 AC를 자극하고, Gαi/o는 AC를 억제한다. 따라서 Gαs 연결 GPCR은 Gαi/o 연결 GPCR 작용에 반한다. 세포질 cAMP 수준은 이온 채널 및 단백질 키나아제 A(PKA) 활성을 결정한다. cAMP는 세컨드 메신저이며, PKA는 2차 이펙터이다.
# Gαq/11 경로의 이펙터는 포스포리파제 C-β(PLCβ)로, 포스파티딜이노시톨 4,5-이중인산(PIP2)를 이노시톨 (1,4,5) 삼인산(IP3)과 디아실글리세롤(DAG)로 분해한다. IP3는 IP3 수용체에 작용하여 소포체(ER)에서 Ca2+ 방출을 유발하며, DAG는 단백질 키나아제 C(PKC)를 활성화한다. PKC의 많은 아이소폼이 Ca2+ 증가에 의해 활성화되므로, 두 경로는 합쳐져 동일한 2차 이펙터를 통해 신호를 전달한다. 증가된 Ca2+는 칼모듈린에 결합하여 알로스테릭하게 활성화하며, 이들은 세포질 소형 GTPase, Rho를 활성화한다. Rho는 세포 골격 조절 단백질(예: Rho-키나아제(ROCK))을 활성화한다. Gα12/13에 연결되는 대부분의 GPCR은 Gαq/11에도 연결된다.
위 설명은 Gβγ 신호 전달 효과를 무시하는데, 이는 활성화된 Gαi/o 결합 GPCR의 경우 중요할 수 있다. Gβγ의 주요 이펙터는 이온 채널(G 단백질 조절 내향성 정류 K+ 채널(GIRK), P/Q 및 N-형 전압 개폐 Ca2+ 채널)과 일부 AC 및 PLC, PI3K 이소폼이다.
5. 2. β-아레스틴 매개 신호 전달
G 단백질 연결 수용체 키나아제(GRK)에 의해 인산화된 G 단백질 연결 수용체(GPCR)는 β-아레스틴과 결합한다.[48] β-아레스틴은 GPCR이 G 단백질과 접촉하는 것을 방해하여 신호 전달을 억제하고, 탈감작을 유도한다. 또한, β-아레스틴은 식작용(세포 내 이입, internalization)을 유도하며, 자체적인 신호 전달 경로를 활성화시킬 수 있다고 알려져 있다.β-아레스틴의 식작용 기작은 먼저 수용체에 결합된 β-아레스틴이 유비퀴틴화된 후, G 단백질과 같은 중매제가 결합하면서 시작된다. 이후 결합된 G 단백질은 여러 모터 단백질과 접촉하여 리간드, 수용체, 막의 응집을 촉진한다. 이렇게 형성된 소포(vesicle)는 세포 내에서 수용체나 리간드가 필요한 곳으로 이동하거나 리소좀에 의해 분해된다. β-아레스틴의 신호 전달 체계는 최근 많은 연구를 통해 밝혀지고 있지만, 아직까지 많은 기작이 밝혀지지 않아 현재진행형으로 연구가 진행 중이다.
6. 수용체 조절
G 단백질 연결 수용체(GPCR)는 리간드에 장기간 노출되면 탈감작되어 신호 전달이 약화된다. 탈감작에는 다음 두 가지 형태가 있다.[58]
- 동종 탈감작: 활성화된 GPCR이 하향 조절된다.
- 이종 탈감작: 활성화된 GPCR이 다른 GPCR의 하향 조절을 유발한다.
이러한 하향 조절의 핵심 반응은 단백질 키나아제에 의한 세포 내 (또는 세포질) 수용체 도메인의 인산화이다.[58]
GPCR은 자체적인 GTP→GDP 가수분해 능력으로 인해 스스로 활성화를 종료할 수 있다. 그러나 이 반응은 느리게 진행되기 때문에, RGS 단백질과 같은 다른 요인의 작용으로 가수분해 속도가 가속화된다. RGS 단백질은 GAP 도메인을 통해 Gα에 결합하여 가수분해 속도를 높여, 세포가 외부 신호에 빠르게 반응할 수 있게 한다.[58]
GPCR은 리간드 점유로 인한 입체 구조 변화로 GPCR-조절 키나아제(GRK)를 모집하여 수용체를 인산화시켜 자체적으로 탈감작될 수 있다. GRK 인산화는 GPCR의 β-아레스틴에 대한 친화력을 증가시키고, β-아레스틴은 결합하여 G 단백질 결합을 방해하고 수용체 내재화를 시작한다. 이 메커니즘은 리간드 결합 수용체만 탈감작시키기 때문에 동종 탈감작이라고 한다.[58]
β-아레스틴은 AP-2와 클라트린을 모집하여 막이 안쪽으로 싹트게 한다. 이후 암피피신과 다이나민의 작용으로 구덩이가 원형질막에서 떨어져 나가 엔도사이토시스 소포가 된다. 수용체는 단백질 표적화되어 다시 원형질막으로 이동하거나 리소좀으로 표적화되어 분해된다.[58]
β-아레스틴은 ERK1/2와 같은 신호를 활성화할 수 있다. 또한 c-SRC의 또 다른 표적은 엔도사이토시스에 관여하는 다이나민 분자로, 인산화를 통해 막에서 최종 "분리"를 돕는다.[58]
수용체 탈감작은 인산화, β-arrestin 결합 및 엔도사이토시스를 통해 매개된다. 다운regulation은 내재화된 수용체가 리소좀과 융합되도록 이동하는 엔도솜에 삽입될 때 발생한다. 리소좀의 낮은 pH와 분해 효소는 GPCR을 변성시키고 분해한다.[58]
GPCR 조절은 또한 유전자 전사 인자에 의해 매개되어, 새로운 수용체의 생성을 조절한다.
6. 1. cAMP 의존성 단백질 키나아제에 의한 인산화
단백질 인산화효소 A (PKA)는 G 단백질에서 아데닐산 시클라제와 사이클릭 AMP (cAMP)를 통해 전달되는 신호 사슬에 의해 활성화된다. 활성화된 PKA는 ''피드백 메커니즘''을 통해 수용체를 인산화하여 탈감작을 일으킨다.[51] 수용체가 활성 상태를 오래 유지할수록 더 많은 PKA가 활성화되고 더 많은 수용체가 인산화된다. 베타-2 아드레날린 수용체에서 이러한 인산화는 G 단백질의 Gs 클래스에서 Gi 클래스로의 결합 전환을 초래한다.[51] cAMP 의존성 PKA 매개 인산화는 활성화된 수용체 이외의 수용체에서도 이종 탈감작을 유발할 수 있다.[52]6. 2. GRK에 의한 인산화
G 단백질 연결 수용체 키나아제(GRK)는 활성화된 G 단백질 연결 수용체(GPCR)만을 인산화하는 단백질 키나아제이다.[53] GRK는 G 단백질 연결 수용체(GPCR) 신호 전달의 핵심 조절자이며, 효능제 결합 수용체를 인산화하는 7개의 포유류 세린-트레오닌 단백질 키나아제 계열을 구성한다. GRK 매개 수용체 인산화는 수용체 신호 전달과 탈감작을 급격하게 손상시킨다.[54]GRK에 의한 수용체 인산화는 두 가지 결과를 초래할 수 있다.
- 아레스틴 연결: 인산화된 수용체는 G 단백질 결합 및 활성화를 방지하는 ''아레스틴'' 분자와 연결되어 단기간 동안 수용체를 비활성화한다. 이 메커니즘은 밝은 빛에 대한 노출을 보상하기 위해 망막 세포의 로돕신과 함께 사용된다. 많은 경우, 아레스틴의 수용체 결합은 세포 내 이입(internalization, 전위)의 전제 조건이다. 예를 들어, β2-아드레날린 수용체에 결합된 베타-아레스틴은 클라트린 및 AP2의 베타-소단위체(클라트린 어댑터 분자)와의 결합을 위한 어댑터 역할을 한다. 따라서 여기에서 아레스틴은 β2-아드레날린 수용체의 클라트린 매개 엔도사이토시스에 필요한 구성 요소를 조립하는 스캐폴드 역할을 한다.[56][57]
- 전위(Translocation): 수용체는 세포 내로 이동하여 산성 소포 환경 내에서 탈인산화된 다음 다시 돌아온다.[55] 이 메커니즘은 탈감작 이후 재감작을 허용하여, 호르몬에 대한 장기간 노출을 조절하는 데 사용된다. 또는 수용체는 리소좀 분해를 겪거나, 신호 전달 사건의 개시를 시작하는 데 참여한다고 생각되는 내부화된 상태로 남아 있을 수 있으며, 이 사건의 특성은 내부화된 소포의 세포 내 위치에 따라 달라진다.[52]
리간드 점유의 직접적인 결과로, 입체 구조의 변화는 GPCR-조절 키나아제(GRK)를 모집할 수 있으며, 이는 IL-3 및 C-말단 꼬리의 다양한 세린/트레오닌 잔기를 인산화한다. GRK 인산화 시, GPCR의 β-아레스틴(대부분의 조직에서 β-아레스틴-1/2)에 대한 친화력이 증가하며, 이 시점에서 β-아레스틴은 결합하여 G 단백질 결합을 입체적으로 방해하고 수용체 내재화 과정을 클라트린 매개 엔도사이토시스를 통해 시작할 수 있다. 이 메커니즘에 의해 리간드 결합 수용체만 탈감작되기 때문에 이를 동족 탈감작이라고 한다.
7. 의학적 가치
GPCR은 다양한 생리적 기능 조절에 관여하며, 많은 질병과 연관되어 있어 신약 개발의 주요 표적이 된다. GPCR을 표적으로 하는 약물 개발은 리간드의 친화력, 효능, 신호 전달 경로 선택성("biased agonist") 등을 고려해야 한다.[2] 구조 기반 약물 설계(In silico docking) 등 새로운 기법이 GPCR 표적 약물 개발에 활용되고 있다. GPCR의 역동적인 특성을 이해하는 것이 약물 개발에 중요하다.[2]
리간드는 친화력(리간드와 수용체간의 상호 작용의 세기)과 내부적 효험(수용체에 결합한 리간드가 얼마나 반응을 잘 유도할 수 있는가)의 특성에 따라서 크게 4개의 종류(full agonist, partial agonist, neutral agonist, inverse agonist)로 나눌 수 있다.[2]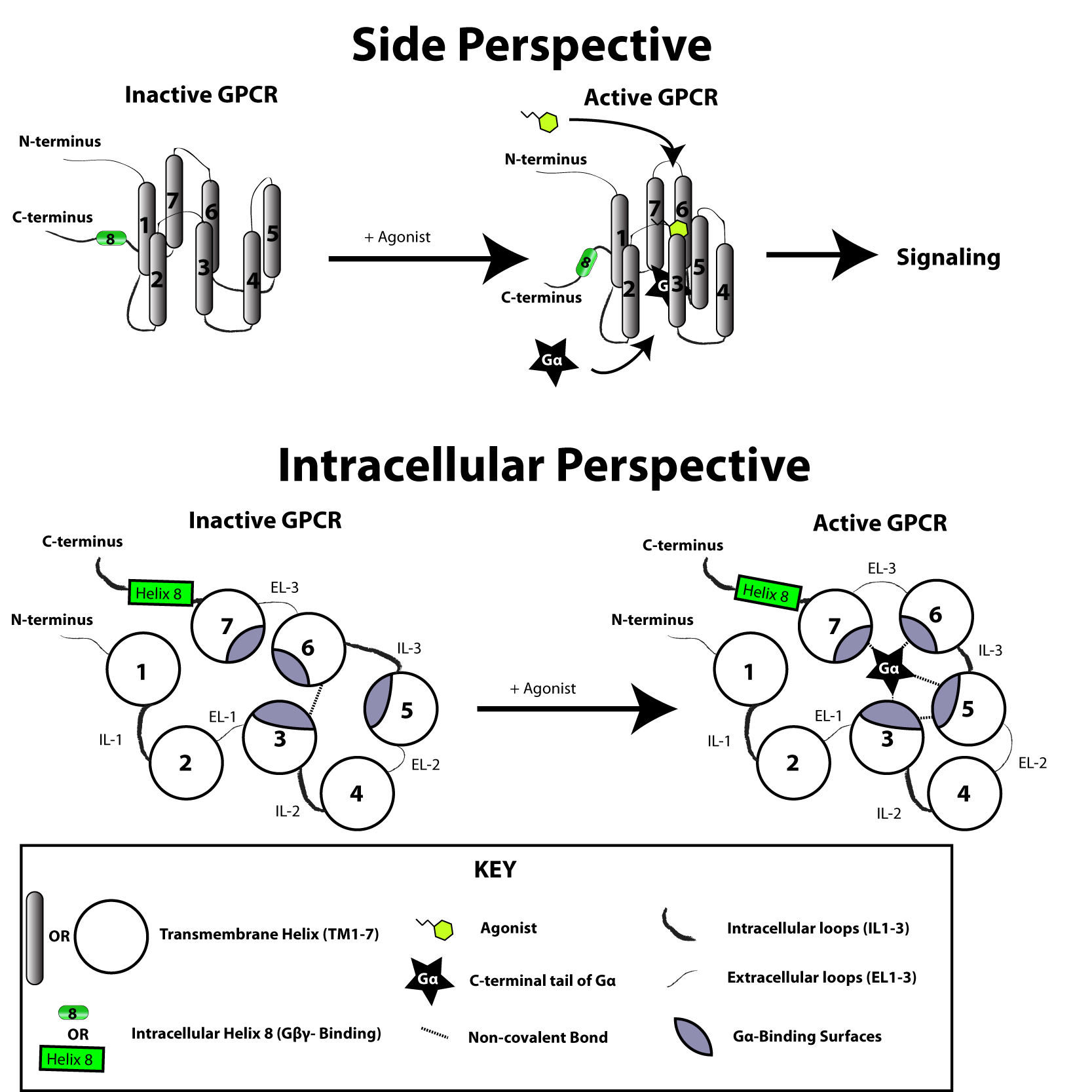
최근에는 구조 기반 약물 개발 기법 또한 많이 이용되고 있다. 구조 기반 약물 탐색은 후보 중에서의 최적화 및 새로운 약을 찾을 수 있게 한다. 대표적인 예가 In silico docking method인데, 이 기법은 full agonist와 partial agonist가 활성화된 형태를 안정화시키고 antagonist가 비활성화된 형태를 안정화시킨다는 것에 착안하여 리간드에 결합한 GPCR을 정제하는 방법이다.[2]
2012년 노벨 화학상은 "G 단백질 연결 수용체의 기능 방식을 이해하는 데 결정적인" 업적을 이룬 브라이언 코빌카와 로버트 레프코위츠에게 수여되었다.[7] G 단백질 매개 신호 전달의 일부 측면에 대해 최소 7개의 다른 노벨상이 수여되었다. 2012년 기준으로, 세계 10대 베스트셀러 약물 중 2개(Advair Diskus 및 Abilify)는 G 단백질 연결 수용체를 표적으로 하여 작용한다.[8] 2018년에 발표된 의약 산업 정책 연구소의 조사에 따르면, GPCR 표적 신약 개발 품목 수는 개발약 전체의 20% (253/1265)를 차지하며, 주요 표적 분자군 중 하나가 되었다.[69]
G 단백질 연결 수용체는 다음과 같은 리간드에 대한 하나 이상의 수용체를 포함한다.
- 감각 신호 매개체(예: 빛 및 후각 자극 분자)
- 아데노신, 봄베신, 브라디키닌, 엔도텔린, γ-아미노부티르산(GABA), 간세포 성장 인자(HGF), 멜라노코르틴, 신경펩티드 Y, 오피오이드 펩티드, 옵신, 소마토스타틴, 성장 호르몬(GH), 타키키닌, 혈관 활성 장 펩티드 계열 구성원, 바소프레신
- 바이오제닉 아민 (예: 도파민, 에피네프린, 노르에피네프린, 히스타민, 세로토닌, 멜라토닌)
- 글루탐산 (대사성 효과)
- 글루카곤
- 아세틸콜린 (무스카린 효과)
- 케모카인
- 염증의 지질 매개체 (예: 프로스타글란딘, 프로스타노이드, 혈소판 활성 인자, 류코트리엔)
- 펩티드 호르몬 (예: 칼시토닌, C5a 아나필락시독소, 난포 자극 호르몬(FSH), 생식샘 자극 호르몬 방출 호르몬(GnRH), 신경키닌, 갑상선 자극 호르몬 방출 호르몬(TRH), 옥시토신)
- 및 내인성 칸나비노이드
8. 생리적 역할
G 단백질 연결 수용체(GPCR)는 세포 외부의 신호를 세포 내부로 전달하여 다양한 생리적 과정에 관여한다. 주요 역할은 다음과 같다.
- 감각 수용:
- 시각: 옵신은 빛을 세포 신호로 바꾼다. 예를 들어 로돕신은 ''11-시스''-레티날을 ''올-트랜스''-레티날로 전환한다.[2]
- 미각: 쓴맛, 감칠맛, 단맛을 감지하여 구스타이신 방출을 매개한다.[2]
- 후각: 후각 상피의 수용체가 냄새 물질(후각 수용체) 및 페로몬(서골 코 수용체)과 결합한다.[2]
- 신경 전달: 포유류 뇌에서 세로토닌, 도파민, 히스타민, GABA, 글루탐산 등 다양한 신경전달물질과 결합하여 행동 및 기분을 조절한다.[2]
- 면역 조절: 케모카인 수용체는 면역 세포 간 통신을 매개하고, 히스타민 수용체 등은 염증 반응을 유발한다. GPCR은 TLR 유도 면역 반응을 조절하여 면역 조절에도 관여한다.[20][21]
- 자율 신경계 조절: 교감 신경계와 부교감 신경계를 조절하여 혈압, 심박수, 소화 등 자동 기능을 제어한다.[2]
- 항상성 조절: 세포 밀도 감지, 수분 균형[22] 등 항상성 유지에 관여한다.
- 기타: 종양 성장 및 전이[23], 호르몬 작용 등에도 관여한다.
G 단백질 연결 수용체는 다음과 같은 다양한 리간드와 결합한다.
- 감각 신호 매개체 (빛, 후각 자극 분자 등)[2]
- 아데노신, 봄베신, 브라디키닌, 엔도텔린, GABA, 간세포 성장 인자(HGF), 멜라노코르틴, 신경펩티드 Y, 오피오이드 펩티드, 옵신, 소마토스타틴, 성장 호르몬(GH), 타키키닌, 혈관 활성 장 펩티드 계열, 바소프레신[2]
- 바이오제닉 아민 (도파민, 에피네프린, 노르에피네프린, 히스타민, 세로토닌, 멜라토닌 등)[2]
- 글루탐산 (대사성 효과)[2]
- 글루카곤[2]
- 아세틸콜린 (무스카린 효과)[2]
- 케모카인[2]
- 염증의 지질 매개체 (프로스타글란딘, 프로스타노이드, 혈소판 활성 인자, 류코트리엔 등)[2]
- 펩티드 호르몬 (칼시토닌, C5a 아나필락시독소, 난포 자극 호르몬(FSH), 생식샘 자극 호르몬 방출 호르몬(GnRH), 신경키닌, 갑상선 자극 호르몬 방출 호르몬(TRH), 옥시토신 등)[2]
- 내인성 칸나비노이드[2]
아직 리간드가 밝혀지지 않은 G 단백질 연결 수용체는 고아 수용체라고 불린다.[2]
참조
[1]
논문
Progress in Molecular Biology and Translational Science
Academic Press
2023-10-24
[2]
논문
Action of molecular switches in GPCRs--theoretical and experimental studies
[3]
논문
Evolution of key cell signaling and adhesion protein families predates animal origins
2003-07-00
[4]
논문
G proteins: transducers of receptor-generated signals
[5]
논문
Mammalian G proteins and their cell type specific functions
2005-10-00
[6]
논문
Pharmacogenomics of GPCR Drug Targets
2018-01-00
[7]
뉴스
The Nobel Prize in Chemistry 2012 Robert J. Lefkowitz, Brian K. Kobilka
https://www.nobelpri[...]
2012-10-10
[8]
논문
The top prescription drugs of 2012 globally: biologics dominate, but small molecule CNS drugs hold on to top spots
2013-06-00
[9]
논문
Comprehensive repertoire and phylogenetic analysis of the G protein-coupled receptors in human and mouse
2006-09-00
[10]
웹사이트
keyword:"G-protein coupled receptor [KW-0297]" AND organism:"Homo sapiens (Human) [9606]" in UniProtKB
https://www.uniprot.[...]
2019-06-24
[11]
논문
Phylogenetic analysis of 277 human G-protein-coupled receptors as a tool for the prediction of orphan receptor ligands
2002-10-00
[12]
논문
Fingerprinting G-protein-coupled receptors
1994-02-00
[13]
논문
GCRDb: a G-protein-coupled receptor database
[14]
논문
International Union of Pharmacology. XLVI. G protein-coupled receptor list
2005-06-00
[15]
웹사이트
InterPro
https://www.ebi.ac.u[...]
2007-12-10
[16]
논문
The G protein-coupled receptor repertoires of human and mouse
2003-04-00
[17]
논문
GPCR-CA: A cellular automaton image approach for predicting G-protein-coupled receptor functional classes
https://www.jci-bioi[...]
2009-07-00
[18]
논문
Prediction of G-protein-coupled receptor classes based on the concept of Chou's pseudo amino acid composition: an approach from discrete wavelet transform
2009-07-00
[19]
논문
Prediction of G-protein-coupled receptor classes in low homology using Chou's pseudo amino acid composition with approximate entropy and hydrophobicity patterns
2010-05-00
[20]
논문
Cannabinoid Receptor 2 (CB2) Signals via G-alpha-s and Induces IL-6 and IL-10 Cytokine Secretion in Human Primary Leukocytes
2019-12-00
[21]
논문
Sphingosine-1-phosphate suppresses TLR-induced CXCL8 secretion from human T cells
2013-04-00
[22]
논문
G protein-coupled receptors in the hypothalamic paraventricular and supraoptic nuclei--serpentine gateways to neuroendocrine homeostasis
2012-01-00
[23]
논문
G-protein-coupled receptors and cancer
2007-02-00
[24]
논문
Molecular signatures of G-protein-coupled receptors
2013-02-00
[25]
논문
Insights into the structure of class B GPCRs
2014-01-00
[26]
논문
Crystal structure of rhodopsin: A G protein-coupled receptor
2000-08-00
[27]
논문
Crystal structure of the human beta2 adrenergic G-protein-coupled receptor
2007-11-00
[28]
논문
High-resolution crystal structure of an engineered human beta2-adrenergic G protein-coupled receptor
2007-11-00
[29]
논문
GPCR engineering yields high-resolution structural insights into beta2-adrenergic receptor function
2007-11-00
[30]
논문
Structure of a nanobody-stabilized active state of the β(2) adrenoceptor
2011-01-00
[31]
논문
Structure and function of an irreversible agonist-β(2) adrenoceptor complex
2011-01-00
[32]
논문
The structural basis for agonist and partial agonist action on a β(1)-adrenergic receptor
2011-01-00
[33]
논문
Structure of an agonist-bound human A2A adenosine receptor
2011-04-00
[34]
논문
Crystal structure of the β2 adrenergic receptor-Gs protein complex
2011-07-00
[35]
논문
Cloning of adiponectin receptors that mediate antidiabetic metabolic effects
2003-06-00
[36]
논문
Inactive-state preassembly of G(q)-coupled receptors and G(q) heterotrimers
2011-08-00
[37]
논문
beta-Arrestin: a protein that regulates beta-adrenergic receptor function
1990-06-00
[38]
논문
The role of beta-arrestins in the termination and transduction of G-protein-coupled receptor signals
2002-02-00
[39]
논문
Distinct conformations of GPCR-β-arrestin complexes mediate desensitization, signaling, and endocytosis
2017-03-00
[40]
논문
Functional competence of a partially engaged GPCR-β-arrestin complex
2016-11-00
[41]
논문
GPCR-G Protein-β-Arrestin Super-Complex Mediates Sustained G Protein Signaling
2016-08-00
[42]
논문
Structure of an endosomal signaling GPCR-G protein-β-arrestin megacomplex
2019-12-00
[43]
논문
The year in G protein-coupled receptor research
2010-01-00
[44]
논문
Thrombin and platelet activation
2003-09-00
[45]
논문
Some G protein heterotrimers physically dissociate in living cells
2006-11-00
[46]
논문
Activation of G protein-coupled receptors entails cysteine modulation of agonist binding
https://cogprints.or[...]
2006-01-14
[47]
논문
Integrin and GPCR Crosstalk in the Regulation of ASM Contraction Signaling in Asthma
[48]
논문
Biased agonists of the chemokine receptor CXCR3 differentially control chemotaxis and inflammation
2018-11-00
[49]
논문
Social senses: G-protein-coupled receptor signaling pathways in Dictyostelium discoideum
1996-04-00
[50]
논문
A novel protein-protein interaction between a G protein-coupled receptor and the phosphatase SHP-2 is involved in bradykinin-induced inhibition of cell proliferation
2002-10-00
[51]
논문
G(i)-dependent localization of beta(2)-adrenergic receptor signaling to L-type Ca(2+) channels
2000-11-00
[52]
논문
Membrane trafficking of G protein-coupled receptors
[53]
논문
G-protein-coupled receptor kinase 2 and hypertension: molecular insights and pathophysiological mechanisms
2013-03-00
[54]
논문
Mechanisms of regulation of the expression and function of G protein-coupled receptor kinases
2003-11-00
[55]
논문
The role of sequestration in G protein-coupled receptor resensitization. Regulation of beta2-adrenergic receptor dephosphorylation by vesicular acidification
1997-01-00
[56]
논문
The interaction of beta-arrestin with the AP-2 adaptor is required for the clustering of beta 2-adrenergic receptor into clathrin-coated pits
2000-07-00
[57]
논문
The beta2-adrenergic receptor/betaarrestin complex recruits the clathrin adaptor AP-2 during endocytosis
1999-03-00
[58]
논문
G-protein-coupled receptor phosphorylation: where, when and by whom
2008-03-00
[59]
논문
A trafficking checkpoint controls GABA(B) receptor heterodimerization
2000-07-00
[60]
논문
Heterodimerization is required for the formation of a functional GABA(B) receptor
1998-12-00
[61]
논문
The origin of GPCRs: identification of mammalian like Rhodopsin, Adhesion, Glutamate and Frizzled GPCRs in fungi
[62]
논문
Independent HHsearch, Needleman--Wunsch-based, and motif analyses reveal the overall hierarchy for most of the G protein-coupled receptor families
2011-09-00
[63]
문서
seven transmembrane receptor、7TM
[64]
문서
large G protein
[65]
논문
It's a GPCR world
http://pubs.acs.org/[...]
American Chemical Society
[66]
논문
Crystal structure of rhodopsin: A G protein-coupled receptor.
[67]
논문
Crystal structure of the human β2-adrenergic G-protein-coupled receptor
[68]
뉴스
The Nobel Prize in Chemistry 2012 Robert J. Lefkowitz, Brian K. Kobilka
http://www.nobelpriz[...]
2012-10-10
[69]
웹사이트
特集:GPCR創薬研究
https://www.cosmobio[...]
コスモ・バイオ
2021-02-17
[70]
논문
Fingerprinting G-protein-coupled receptors
http://peds.oxfordjo[...]
[71]
논문
GCRDb: a G-protein-coupled receptor database
[72]
논문
International Union of Pharmacology. XLVI. G protein-coupled receptor list
[73]
웹사이트
InterPro
http://www.ebi.ac.uk[...]
[74]
논문
Phylogenetic analysis of 277 human G-protein-coupled receptors as a tool for the prediction of orphan receptor ligands
[75]
논문
Comprehensive repertoire and phylogenetic analysis of the G protein-coupled receptors in human and mouse
[76]
논문
Electron-crystallographic refinement of the structure of bacteriorhodopsin
[77]
논문
Surface of bacteriorhodopsin revealed by high-resolution electron crystallography
[78]
논문
X-ray structure of bacteriorhodopsin at 2.5 angstroms from microcrystals grown in lipidic cubic phases
[79]
논문
Crystal structure of rhodopsin: A G protein-coupled receptor.
[80]
논문
Crystal structure of the human β2-adrenergic G-protein-coupled receptor
[81]
논문
High-resolution crystal structure of an engineered human β2-adrenergic G protein-coupled receptor
[82]
논문
GPCR engineering yields high-resolution structural insights into β2-adrenergic receptor function
[83]
논문
Structure of the human dopamine D3 receptor in complex with a D2/D3 selective antagonist.
http://www.ncbi.nlm.[...]
[84]
논문
Structures of the CXCR4 chemokine GPCR with small-molecule and cyclic peptide antagonists.
http://www.ncbi.nlm.[...]
[85]
논문
Structure of a beta1-adrenergic G-protein-coupled receptor.
http://www.ncbi.nlm.[...]
[86]
서적
理工系のための生物学
裳華房
2015-08-10
[87]
논문
Crystal structure of the beta(2) adrenergic receptor-Gs protein complex
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

![인간 [[베타-2 아드레날린 수용체]]와 [[카라졸롤]]의 복합체](https://cdn.onul.works/wiki/noimage.png)